เผยบริษัทต้นทางมาจากจีน
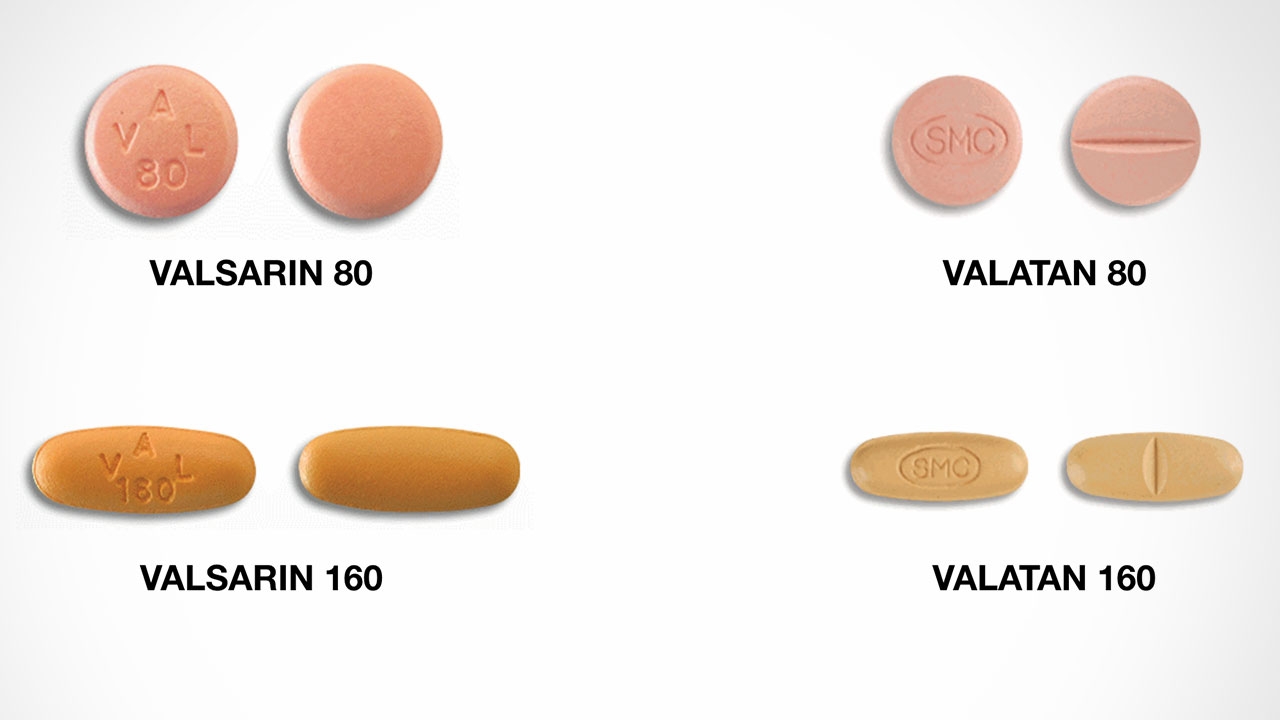
นพ.วันชัย สัตยาวุฒิพงศ์ เลขาธิการคณะกรรมการอาหารและยา (อย.) เปิดเผยว่า ตามที่มีการเรียกเก็บคืนผลิตภัณฑ์ยาวาลซาร์แทน (Valsartan) ซึ่งเป็นยารักษาโรคความดันโลหิตสูงใน 22 ประเทศทั่วโลก เนื่องจากพบสารก่อมะเร็งในวัตถุดิบที่ใช้ในการผลิตยา โดยบริษัท Zhejiang Huahai Pharmaceuticals ซึ่งเป็นผู้ผลิตวัตถุดิบวาลซาร์แทนในสาธารณรัฐประชาชนจีน ได้ออกมายอมรับถึงความผิดพลาดดังกล่าว ว่าเกิดจากการเปลี่ยนแปลงกระบวนการผลิตวัตถุดิบนั้น ในประเทศไทยมีบริษัทผู้รับอนุญาตผลิต/นำหรือสั่งยาวาลซาร์แทนเข้ามาในราชอาณาจักรจำนวน 7 บริษัท และมีทะเบียนตำรับยาที่ได้รับอนุญาตให้จำหน่ายจำนวน 14 ตำรับ ซึ่งจากการตรวจสอบพบว่า มีบริษัทผู้รับอนุญาตที่ใช้วัตถุดิบจากบริษัท Zhejiang Huahai Pharmaceuticals เพียง 2 ราย ได้แก่ บริษัท สีลมการแพทย์ จำกัด และบริษัท ยูนีซัน จำกัด
ซึ่งมีเลขทะเบียนตำรับ รวม 5 ตำรับ ได้แก่ 1. บริษัท สีลมการแพทย์ จำกัด 2 ทะเบียนตำรับ ได้แก่ 1.ยา VALATAN 80 ทะเบียนตำรับยาเลขที่ 1A 9/54 (NG) 2. ยา VALATAN 160 ทะเบียนตำรับยาเลขที่ 1A 10/54 (NG) และ 2. บริษัท ยูนีซัน จำกัด 3 ทะเบียนตำรับ ได้แก่ 1. ยา VALSARIN 80 ทะเบียนตำรับยาเลขที่ 1A 4/60 (NG) 2. ยา VALSARIN 160 ทะเบียนตำรับยาเลขที่ 1A 5/60 (NG) และ 3. ยา VALSARIN 320 ทะเบียนตำรับยาเลขที่ 1A 6/60 (NG)
เลขาธิการ อย. กล่าวต่อว่า อย.เล็งเห็นถึงความไม่ปลอดภัยจากการใช้ยาที่มีการปนเปื้อนสารก่อมะเร็ง จึงมีมาตรการให้เรียกเก็บผลิตภัณฑ์ยาวาลซาร์แทน เลขทะเบียนตำรับของทั้ง 2 บริษัทในทุกรุ่นการผลิตคืนจากท้องตลาดภายใน 15 วัน พร้อมทั้งมีคำสั่งให้ผู้รับอนุญาตผลิตยาทั้งสองแห่งระงับการผลิตและจำหน่ายผลิตภัณฑ์ยาวาลซาร์แทน ทุกทะเบียนที่มีการใช้วัตถุดิบวาลซาร์แทนจากแหล่งผลิตดังกล่าวเป็นการชั่วคราว รวมทั้งระงับการจำหน่ายเภสัชเคมีภัณฑ์วาลซาร์แทน ที่มาจากแหล่งผลิตดังกล่าว และ อย.จะดำเนินการควบคุมการทำลายต่อไป อย่างไรก็ตาม การปนเปื้อนสารก่อมะเร็งนี้ เกิดจากกระบวนการผลิตวัตถุดิบ ไม่ได้เกิดจากความผิดพลาดในการผลิตยาสำเร็จรูป ทั้งนี้ขอให้ประชาชนอย่าหวั่นวิตก เพราะ อย.มีการตรวจสอบผลจากการใช้ยาที่ขึ้นทะเบียนในไทยอย่างเข้มงวด.
...